

近年来,免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)为晚期驱动基因阴性NSCLC的治疗带来重大突破,患者5年生存率从化疗时代的5%提升至13.4%~23.2%,ICIs已成为晚期NSCLC标准治疗。但以EGFR基因突变为代表的驱动基因阳性NSCLC既往一直被认为是免疫治疗的“禁区”,随着对靶向药物免疫调节作用的深入认识及临床证据的不断生成,免疫治疗有望为驱动基因阳性NSCLC患者带来新希望。由于驱动基因突变和靶向治疗对于免疫微环境的影响较为复杂,临床治疗选择也存在较多争议,亟需规范化引导。在此背景下,中国抗癌协会肿瘤精准治疗专业委员会和中华医学会杂志社肺癌研究协作组共同组织多学科专家针对驱动基因阳性NSCLC免疫相关肿瘤及肿瘤微环境(tumor microenvironment, TME)特征和动态变化、ICIs临床疗效和安全性管理等多方面问题进行深入研讨,形成专家共识,旨在更好地指导临床实践。
共识意见 1
不推荐ICIs用于晚期初治EGFR敏感突变NSCLC患者(推荐程度:一致不推荐)。
EGFR突变与肿瘤免疫原性低及非炎症性微环境有关,且早期临床研究表明,ICIs单药或ICIs联合化疗治疗初治EGFR敏感突变患者疗效远不及标准EGFR-TKIs靶向治疗,然而,在EGFR-TKIs基础上联合ICIs的疗效提升有限,且存在较大安全性风险。
共识意见 2
推荐耐药的EGFR突变患者再次活检,同时检测肿瘤耐药基因和免疫微环境相关的生物标志物(推荐程度:一致推荐)。
基于EGFR-TKIs治疗会影响肿瘤特征和TME,建议条件允许的情况下应再次活检,为后续精准治疗提供依据。检测标本优选肿瘤组织,组织标本无法获得时可以采用其他类型标本替代;检测范围优选高通量检测以获得全面的耐药信息,包括肿瘤相关和免疫微环境相关的生物标志物。
共识意见 3
对于EGFR-TKIs耐药后发生广泛进展的患者,且在缺乏有效靶向治疗的情况下,推荐使用ICIs(推荐程度:一致推荐)。
对于ICIs的方案选择,应结合患者的体能状态和疾病进展情况进行综合判断,其中ICIs+化疗+抗血管治疗方案的临床证据较为丰富(推荐程度:强推荐);ICIs+含铂化疗方案在多项早期研究中均显示良好的治疗活性,且耐受性方面ICIs+含铂化疗方案较ICIs+含铂化疗+抗血管联合方案具有一定优势(推荐程度:强推荐);ICIs联合抗血管治疗(推荐程度:弱推荐)的证据主要针对多线耐药的患者或体力状况较差不耐受高强度治疗的患者,疗效获益有限。
共识意见 4
不推荐ICIs用于治疗晚期初治ALK融合NSCLC(推荐程度:一致不推荐)。
ALK融合与肿瘤免疫原性低和非炎症性微环境相关。多项早期研究结果一致提示ICIs联合ALK-TKIs治疗ALK融合NSCLC患者的疗效提升有限,其中克唑替尼和塞瑞替尼联合ICIs存在较大安全性风险。
共识意见 5
推荐ICIs联合化疗用于晚期初治KRAS突变NSCLC患者(推荐程度:强推荐)。
KRAS突变与肿瘤免疫原性高和炎症性微环境相关。多项研究一致显示,与单纯化疗比较,KRAS突变患者从ICIs中获益更多,且一线治疗中ICIs联合化疗的获益多于ICIs单药治疗,此外KRAS G12C特异性抑制剂目前国内尚不可及,故针对KRAS突变NSCLC的患者推荐一线使用化疗联合ICIs。
共识意见 6
对于BRAF非V600E突变患者,推荐一线使用ICIs治疗;对于BRAF V600E突变患者,推荐在靶向治疗不可及或耐药后发生广泛进展时考虑使用ICIs治疗(推荐程度:弱推荐)。
BRAF突变特别是非V600E突变与肿瘤免疫原性高和炎症性微环境相关。多项回顾性研究一致显示BRAF突变患者可从ICIs治疗中获益。
共识意见 7
伴有高危风险的患者使用免疫治疗应谨慎,需要多学科评估与密切监测。EGFR-TKIs或ALK-TKIs与ICIs联用存在很高的安全性风险,故不推荐同时使用。EGFR-TKIs和ICIs序贯使用需要关注洗脱期,以避免EGFR-TKIs与ICIs可能的叠加不良反应,洗脱期的设定需要考虑前序药物的半衰期、器官功能恢复情况及疾病进展病情况,平衡治疗安全性与疗效获益(推荐程度:一致推荐)。


全国共有49家实验室报名参加,其中45家提交有效结果,仅23家通过评价活动,通过率为51.1%。

由中国临床肿瘤学会(CSCO)主办的"2020年中国临床肿瘤学年度进展研讨会"近日于线上顺利召开,会上专家学者们对2020CSCO消化道肿瘤指南更新做了总结,近几年颇受关注的免疫治疗在新版指南中地位突显,地位相较于旧版指南有所提升。
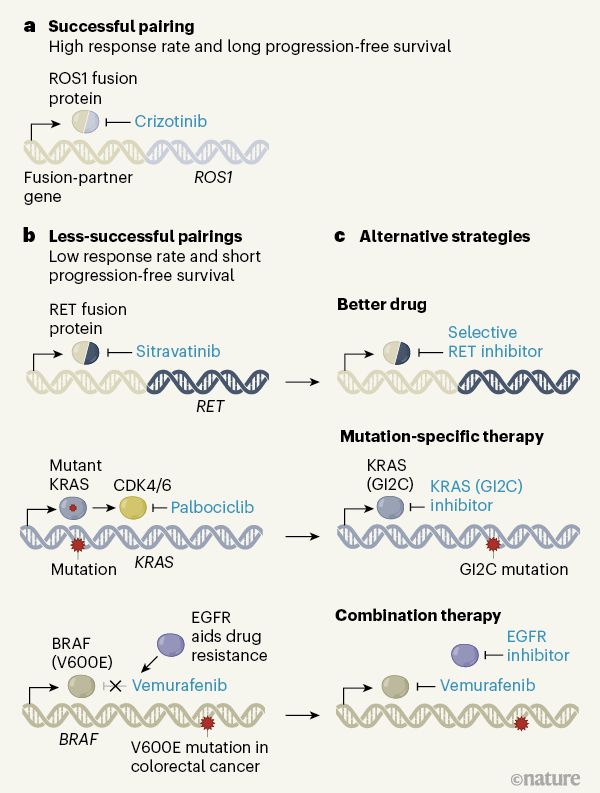
由伯明翰大学癌症研究中心英国临床试验小组领导的一项开拓性的肺癌研究强调了下一波精准医学研究,特别是治疗基因组复杂癌症需要考虑的重要因素。