

同源重组修复(homologous recombination repair,HRR)是DNA双链断裂(double strand break,DSB)的首选修复方式。同源重组修复缺陷(homologous recombination deficiency,HRD)通常指细胞水平上的HRR功能障碍状态,可由HRR相关基因胚系突变或体细胞突变以及表观遗传失活等诸多因素导致,常存在于多种恶性肿瘤中,其中在卵巢癌、乳腺癌、胰腺导管癌、前列腺癌等肿瘤中尤其突出。
HRD会产生特定的、可量化的、稳定的基因组改变,可通过建立基于基因组特征分析的评估体系来预测肿瘤HRD状态及其程度,已成为晚期卵巢癌患者临床应用聚腺苷二磷酸核糖聚合酶[poly(ADP-ribose)polymerase,PARP]抑制剂的新型生物标志物,也可能对乳腺癌、前列腺癌等肿瘤的PARP抑制剂和铂类药物的临床用药具有指导价值。
本共识围绕HRD定义描述、HRD肿瘤临床病理与分子特征、HRD检测的临床应用价值、HRD检测样本选择、HRD检测技术选择与确认、HRD算法标准化及HRD临床检测和应用的问题等关键点,结合国内外应用现状,为临床提供7条HRD临床检测与应用专家共识。希望本专家共识可以提高临床医师及检测等相关人员对HRD临床意义及检测规范的认识,从而更加准确合理地开展HRD检测及结果解读,为患者提供更优质的临床服务。
HRD定义描述
专家共识:HRD通常指细胞水平的HRR障碍状态,HRD会产生可量化的、稳定的基因组改变,目前主要通过LOH、TAI和LST 3个指标的综合检测得出GIS,临床实践中以BRCA1/2 基因致病性突变与GIS评估肿瘤HRD状态。鉴于HRR通路以及细胞信号通路的复杂性,通过临床检测方法实现肿瘤细胞HRD全面而准确的评估仍具挑战。
HRD的临床应用
2.1 HRD肿瘤临床病理及分子特征
专家共识:HRD是恶性肿瘤较为常见的分子标记,卵巢癌、乳腺癌、前列腺癌、胰腺癌发生率较高;HRD阳性卵巢癌、乳腺癌表现出一定的临床病理学特征,BRCA相关的遗传性乳腺癌和卵巢癌表现更显著。HRD是较稳定的恶性肿瘤分子标记,其评估通常不受肿瘤取材部位(同一部位不同病灶或原发和转移病灶)影响。
2.2 HRD临床检测的应用价值
专家共识:HRD临床检测在PARP抑制剂治疗晚期卵巢癌疗效预测中具有重要的应用价值,可对卵巢癌患者进行分层,优化相应治疗决策,最大限度扩大PARP抑制剂临床获益人群;在乳腺癌、胰腺癌、前列腺癌中,其对PARP抑制剂或含铂类药物的临床应用可能也具有潜在的指导价值,相关研究尚在探索中。另外,我国尚无获批的HRD检测试剂,临床实施检测时应依据患者肿瘤类型、分期与诊疗史,并在患者充分知情同意前提下,选择与适应证和(或)拟应用的PARP抑制剂种类最匹配且经严格性能验证的商业试剂盒。
HRD临床检测规范化
对于拟开展HRD项目检测的实验室,应参照《医疗器械监督管理条例》(国务院令第739号)相应要求,并遵照卫生行政部门的管理规定,满足高通量测序的硬件和规范要求。
3.1 HRD检测样本要求
3.1.1 检测样本选择
HRD检测样本为肿瘤组织,分为甲醛固定石蜡包埋组织和新鲜组织,建议优先选择石蜡样本。石蜡包埋组织样本:建议送检3年以内(1年之内更好)的石蜡切片,厚度4~5 μm,10张左右;应由病理医师确定肿瘤类型,并观察肿瘤细胞的含量和数量(肿瘤细胞占比≥30%),以保证有足够的肿瘤细胞用于HRD检测;若肿瘤细胞含量不足,应标记肿瘤细胞区域,并富集肿瘤细胞,尽可能避免出血和坏死区域,以保证检测结果的准确性。新鲜组织样本:手术样本不小于米粒大小(≥10 mg),穿刺样本不少于肉眼可见的1条。样本离体30 min内转移至液氮或置于-80 ℃冰箱保存,亦可先保存于样本保护剂中,然后尽早转移到-80 ℃冰箱保存,防止核酸降解。新鲜组织因评估肿瘤细胞比例困难,故不推荐作为常规检测样本类型,如需使用可采用冷冻切片染色评估肿瘤细胞含量。此外,建议提供患者配对外周血样本作为非肿瘤对照样本,这有助于了解胚系BRCA1/2 和HRR基因突变情况,也有助于HRD评分时进行倍性矫正。方法为采集2~5 mL 血液样本于EDTA 抗凝管中,充分颠倒混匀8~10次,避免血液凝固,常温运送至检测实验室;待测样本置于4 ℃冰箱保存,并在2 h内处理。如需长期保存,应置于-20 ℃冰箱保存,避免反复冻融。
3.1.2 核酸提取与质控建议
专家共识:HRD检测优先选择3年以内的石蜡包埋肿瘤组织,并观察肿瘤细胞的含量和数量,以保证有足够的肿瘤细胞用于检测;若含量不足,应进行富集,尽可能避免出血和坏死区域。新鲜组织不推荐作为常规检测样本类型,若使用需先评估其肿瘤细胞含量。建议提供患者配对外周血作为非肿瘤对照样本,这有助于了解胚系BRCA1/2以及其他HRR相关基因突变情况。
3.2 检测技术选择与确认
HRD的临床检测方法可分为三大类:HRR相关基因突变检测,基因组瘢痕与突变谱系分析以及HRD功能性检测。其中,HRD功能性检测通常是通过评估RAD51在DNA损伤时形成功能性同源重组所需核焦点的能力,实时反馈肿瘤细胞的HRD状态。然而,HRD功能性检测预测PARP抑制剂的临床有效性尚未被证实,且在样本选择、分析体系建立上也存在一定局限性,因此尚难以在临床上规范应用。
3.2.1 HRR相关基因检测
BRCA1/2基因突变是引起HRD最明确的HRR基因,也是迄今为止最理想的PARP抑制剂疗效预测标志物。卵巢癌BRCA胚系突变与体细胞突变对PARP抑制剂的疗效预测具有同等效力。除BRCA1/2 基因外,如RAD51B/C/D、BRIP1、PALB2、NBN、ATM、CHK1/2、CDK12 等HRR相关基因胚系和(或)体细胞突变也会导致肿瘤发生HRD。基于Study19研究的回顾性分析发现,携带CDK12、RAD51B、BRIP1 等基因突变与携带BRCA1/2 基因突变的患者接受奥拉帕利维持治疗获得类似的PFS获益。但是,由于携带上述基因突变的个体较为罕见,相应结果仍需更多前瞻性研究证实。其中,在前列腺癌中尤其重视HRR相关基因检测,在经恩杂鲁胺或醋酸阿比特龙治疗进展后的mCRPC成人患者的奥拉帕利治疗决策中,NCCN指南推荐进行BRCA1、BRCA2、ATM、BARD1、BRIP1、CDK12、CHEK1、CHEK2、FANCL、PALB2、RAD51B、RAD51C、RAD51D、RAD54L以及PPP2R2A 等15个HRR相关基因检测,且检测变异类型应包括点突变、插入/缺失、扩增等。BRCA1和RAD51C启动子甲基化也会导致HRD,通常在肿瘤组织内与BRCA 基因突变互斥,但目前尚缺乏足够证据表明HRR基因启动子甲基化与PARP抑制剂的临床疗效有关,甚至存在相互冲突的研究结果。
3.2.2 基于SNPs的“基因组瘢痕”分析
目前也可以基于SNPs分型评估整个基因组层面的3种“基因组瘢痕”现象(LOH、TAI、LST)的总体情况,并进行HRD评分。HRD基因组瘢痕检测可采用芯片或NGS平台,当前大多已从芯片平台转移至NGS平台。有研究利用TCGA数据库中乳腺癌的SNP-array和WES检测数据,评价不同检测平台数据在HRD数值计算中的差异,结果3个数值均表现出显著相关性。其中,Myriad myChoice CDx和FoundationFocusTM CDx BRCA LOH是当前经诸多前瞻性研究验证的应用最为广泛的商业化试剂盒。Myriad myChoice CDx包含BRCA1/2 基因编码区和54 091个人群SNPs,综合计算LOH、TAI和LST 3个指标,当患者BRCA基因突变阳性或HRD评分超过42分时判定为HRD阳性。FoundationFocusTM CDx BRCA LOH通过覆盖22条染色体上324个基因的3 500个SNPs,计算发生LOH的片段占整个基因组的比例,LOH高的截断值为≥16%,HRD阳性定义为BRCA突变型或BRCA野生型但LOH高。目前我国尚未见批准基于SNPs的“基因组瘢痕”的HRD临床检测试剂盒,Myriad myChoice CDx和FoundationFocusTM CDx BRCA LOH也缺乏应用于中国人群的大样本前瞻性临床研究数据,未来亟待推进相应试剂盒的开发与临床验证工作。此外,相应Panel设计应符合我国人群的分子遗传学特征,SNPs位点的选择应注意把握2个要点:一是位点的分布需相对均匀,以避免某些区域出现未覆盖的情况;二是需要尽可能地覆盖更多的杂合位点。要确保实现上述2个目标,HRD Panel设计上应优先选择中国健康人群频率在0.4~0.6之间的SNPs位点;同时需避免覆盖严重偏离哈迪-温伯格平衡以及探针无法稳定覆盖的位点。
3.2.3 基于突变谱系特征的分析
专家共识:基于SNPs的“基因组瘢痕”分析是当前最具应用前景的HRD临床检测方法,能从BRCA野生型肿瘤患者中有效筛选出PARP抑制剂治疗的潜在获益人群。当前亟待推进我国相应合规试剂盒的开发与验证工作,其SNPs位点选择与Panel设计应着重把握我国人群的分子遗传学特征,并积极倡导联合开展PARP抑制剂前瞻性多中心临床研究验证。
3.3 HRD算法的标准化及精准化
HRD评分是反映肿瘤样本因HRR通路异常而导致的肿瘤样本基因组不稳定的情况,目前主要通过2个步骤计算HRD评分:⑴通过检测关键的HRR基因变异评估产生HRD的原因;⑵通过检测基因组损伤的程度计算基因组不稳定状态的评分;然后综合上述2个步骤的结果评估HRD的状态。前者可通过NGS测序检测发生在HRR通路上的特定基因的变异情况评估,后者主要通过分析肿瘤样本基因组上的SNPs计算基因组不稳定状态的评分。
3.3.1 基于全基因组范围内高密度SNP位点检测的HRD评分计算
目前在临床检测中HRD评分主要应用基于高密度全基因组SNP-array或NGS基因组SNP骨架探针检测结果,并结合与HRD相关基因变异与基因组不稳定的程度进行分析。首先,检测BRCA1/2有害突变、BRCA1启动子甲基化等指标,再通过高密度的SNP位点信息,分析由这些分子机制导致的基因组不稳定情况,汇总LOH、LST、TAI等拷贝数变异指标计算HRD评分,然后进一步通过PARP抑制剂治疗疗效划定HRD 评分的阈值,从而建立完整的HRD检测分析流程。
Myriad myChoice CDx采用的HRD评分算法是通过患者肿瘤样本中的体细胞拷贝数变异(somatic copy number variants,SCNV)程度来反映患者HRD程度,简要的生信分析及HRD评分计算方法有以下几个步骤:⑴对肿瘤样本和对照样本检测范围内的SNP位点的覆盖度进行预处理;⑵将相近的SNP位点合并成同一区段;⑶根据上一步的分段结果确定每个区段的SCNV,确定LOH、LST、TAI分值,进一步汇总为HRD评分。由此可见,HRD评分算法的准确性主要基于患者肿瘤样本SCNV检测的准确性。ASCAT软件计算SCNV时可将肿瘤细胞纯度和整体肿瘤倍性作为重要参数,并将其带入计算,从而得到每个区段的拷贝数,以增加区段拷贝数的检测准确性。针对WGS测序的Sequenza软件通过标准化SNPs覆盖度减少高通量测序带来的噪音,ABSOLUTE和Sclust软件还可以根据患者的体细胞突变情况,通过不同模型的聚类分析展现肿瘤细胞的亚克隆情况,进一步调整SCNV的准确性。
3.3.2 基于WGS或WES的HRD评分计算
基于高密度全基因组SNP-array或NGS基因组SNP骨架探针的检测结果可以对基因组瘢痕进行检测及计算而得到基因组不稳定状态的评分,基于基因组全面覆盖的WGS 或WES方法的检测结果还能同时分析得到高HRD评分肿瘤样本所具有的微同源缺失、COSMIC 突变特征结构变异等基因组学特征。有证据表明综合基因组不稳定状态的评分以及HRD相关基因组学特征获得的HRD评分结果准确度更高。然而,WGS检测所需的高DNA上样量、高测序数据量以及无法涵盖HRR信号通路的体细胞突变等缺点限制了其在临床上的应用。因此,综合检测所需样本量、数据量、体细胞突变,可采用高深度WES加高密度SNPs方法,对肿瘤样本中HRR信号通路中的遗传性突变、体细胞突变及基因组不稳定性状态同时进行全面检测。随着WES检测成本降低及检测技术不断成熟,WES检测有可能成为准确评估HRD的检测方法,为患者接受PARP抑制剂治疗提供精确指导。
3.3.3 人工智能模型辅助HRD评估分析
专家共识:在HRD临床检测中,基于SNPs位点信息进行HRD评分计算的准确度主要依赖于对SCNV的准确分析;同时,通过WGS、WES等检测技术获取更多的基因组信息,有助于进一步提升HRD评分计算的准确度;应用人工智能技术辅助分析HRD的多维度特征,已展示出高效识别HRD阳性人群的潜在优势。必须强调的是,任何一种检测方法、评分计算方法和判断标准在临床正式应用前,都需要经过严格的性能分析与临床效能验证。
3.4 HRD报告建议
3.4.1 HRD报告应包含的内容
⑴基本信息:
①受检者信息,包括姓名、性别、年龄、临床诊断、病理诊断、基因检测史、家族史和临床治疗史等;
②样本信息,包括样本类型、病理号、样本采集时间、送检机构、送检医生、送检日期和报告时间等;
③项目简介,包括检测方法、检测平台、检测内容(包括基因数量、Panel大小等)、文库构建和参考基因组,数据分析流程、软件及版本等。
④样本质量情况,如肿瘤细胞占比。
⑵检测结果:
①质控结果,包括Q30、测序深度、覆盖度等;②BRCA1/2突变状态、HRR相关基因突变状态、HRD评分和结果释义等。
⑶检测结果注释:
①HRD评估,包括BRCA1/2致病性变异、其他涉及HRR信号通路的相关基因变异,表征基因组不稳定性的HRD评分及阈值判定规则,以及联用BRCA1/2有害变异与HRD 评分进行HRD状态判定的规则。
②结果解读,包括是否有明确的阈值说明,不同癌种、不同PARP抑制剂应列明不同阈值与用药的相关性临床试验证据支持,伴随诊断的药物推荐。
③基于BRCA 基因突变阳性患者涉及胚系遗传的提醒,建议其直系亲属检测是否携带该突变。
⑷签字:
检测技术人员及审核人员签字,最终报告应由中级职称或硕士以上学历且具有病理学专业背景、经培训合格的本单位执业医师或授权签字人(高级职称或医学博士学位)审核。
⑸局限性说明:
根据肿瘤类型、受检样本类型、检测Panel以及相关临床研究结果等信息对HRD 临床应用的局限性进行说明。
3.4.2 HRD报告临床解读建议
专家共识:HRD临床检测报告内容除重点描述BRCA1/2 等HRR相关基因变异情况以及GIS计算数值外,还应针对相应癌种的PARP抑制剂疗效预测价值进行解读;HRD评分阈值判定与不同癌种、不同PARP抑制剂及其相应适应证有关。同时,目前尚缺乏HRD评分应用于中国人群PARP抑制剂疗效预测的大样本临床研究数据,报告应着重阐述其检测的局限性。
HRD临床检测和应用的问题与展望
目前临床上主要通过检测基因组瘢痕或HRR基因突变间接评估HRD的状态,但哪些生物标志物应纳入HRD状态评估尚无统一标准,在HRD评估中也还有许多问题亟待解决:
⑴HRR通路基因分布广泛,与其他通路有交叉情况,国内外对HRR基因的定义不明确,缺乏统一标准;
⑵不同HRR基因的功能不同,其在HRD评估中的作用缺乏量化指标;
⑶HRD发生的机制复杂,单纯HRR通路基因突变检测可能造成HRD结果假阴性,因此检测结果阴性不能排除HRD;
⑷大片段缺失等变异类型需要在HRD评估中充分考虑并进行验证;
⑸基因组瘢痕是HRD的表现形式,只能反映某段时间的基因组不稳定状态,而不能准确评估回复突变导致的同源重组功能重建情况;
⑹不同的HRD评估方法及HRD评分算法是非等效的,各种评估方法的预测效能和检测结果一致性等尚缺乏标准化验证方案;
⑺HRD检测的标准品选择及性能验证方法有待完善;
⑻不同肿瘤类型的HRD评分阈值可能不同,因此需要通过临床试验评估不同肿瘤类型HRD阈值对铂类药物或PARP抑制剂的疗效预测效能。
HRD作为泛癌种生物标志物在临床应用中还处于起始阶段,泛癌种中HRD与免疫检查点抑制剂的相关性值得进一步研究。目前国内外有多个研究机构正在多癌种中开展HRD评分状态与HRR相关基因,以及与免疫检查点抑制剂单药或联合用药疗效相关性的临床试验。在2021年的美国妇科肿瘤学会(SGO)年会上公布了一项Ⅲ期临床试验,该研究首次探索了免疫检查点抑制剂在BRCA1/2突变和HRD卵巢癌患者中的疗效,以及BRCA1/2突变和HRD与肿瘤突变负荷的相关性。
总之,HRD检测和临床应用的标准化仍任重而道远,但其应用前景值得期待。未来随着基因检测技术的飞速发展,HRD评估方法的不断完善,以及越来越多临床医师、病理医师、分子检测人员、临床药师和肿瘤生物学专家更深入和广泛地参与肿瘤精准医疗,相信HRD的精准评估将会进一步提高肿瘤诊疗水平,让更多肿瘤患者获益。


全国共有49家实验室报名参加,其中45家提交有效结果,仅23家通过评价活动,通过率为51.1%。

由中国临床肿瘤学会(CSCO)主办的"2020年中国临床肿瘤学年度进展研讨会"近日于线上顺利召开,会上专家学者们对2020CSCO消化道肿瘤指南更新做了总结,近几年颇受关注的免疫治疗在新版指南中地位突显,地位相较于旧版指南有所提升。
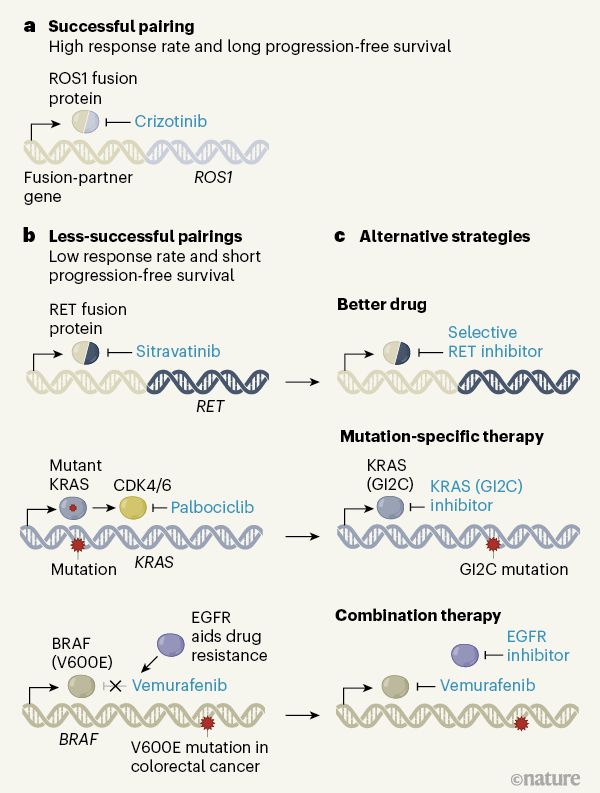
由伯明翰大学癌症研究中心英国临床试验小组领导的一项开拓性的肺癌研究强调了下一波精准医学研究,特别是治疗基因组复杂癌症需要考虑的重要因素。